Az alábbi szimulációs ábra vázlatosan bemutatja, mi történik a testünkben egy 12-24 órás koplalás közben.
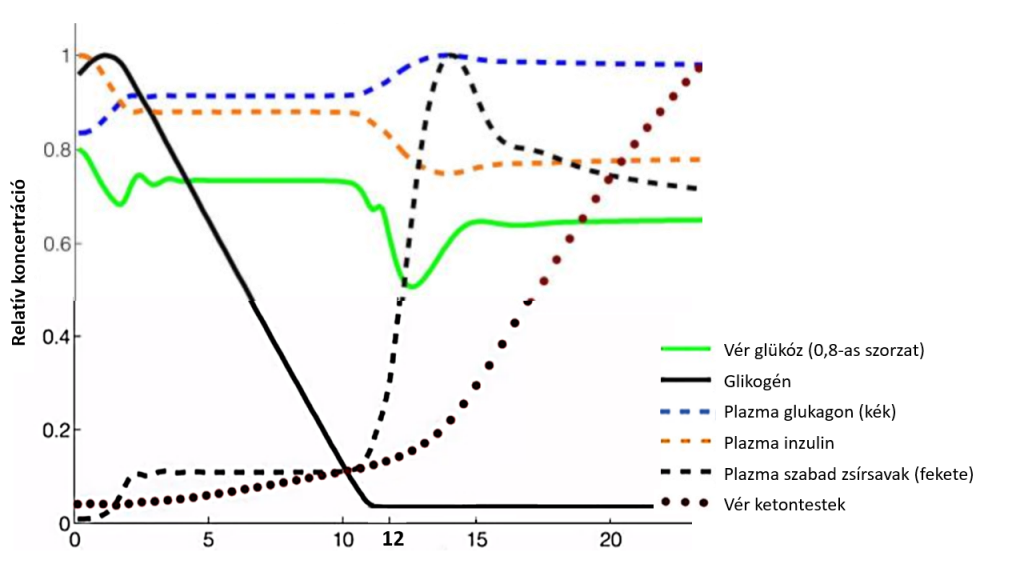
Mint az ábrán látható, az evés után kb. másfél órával beálló vércukor-esés csak az első lépés egy hosszas és összetett folyamatban. Aki tehát evés után másfél-két órával újra eszik, az egy hurokba kerül: ismét visszajut az emésztés első fázisába, és szinte sosem lép ki a glükózanyagcsere ciklusból. (Ezt példázzák azok a súlyos állapotú túlevők, akik néha éjjel is felkelnek enni.) A glükóz-tartalékok kimerülése fokozatosan megy végbe: a vérben és az izmokban tárolt glükóz nagyjából 12 óra alatt elhasználódik, de mivel az átállás fokozatos, a jelentősebb változások 24-48 óra koplalás után indulnak be. Átalában ennyi idő szükséges ahhoz, hogy a szervezet ne csak ketózisba, de egyfajta vészüzemmódba álljon át, ahol kímélni kell az izomszövetet, és a test zsírtartalékait használni energiaforrásként.
A böjtölés élettani hatásai
A böjtölésnek rengeteg pozitív hatása van. Ezek közül van fiziológiás, testi szintű változás, és vannak egyéb hatások, amelyek a lelki és spirituális síkon zajlanak.
Egy friss összefoglaló szerint a böjtölés csökkenti az elhízást, javítja az inzulinérzékenységet, csökkenti a magas vérnyomást. Erősíti a kemoterápia mellékhatásait, és feltételezhetően védi a normál sejteket a kemoterápia során. Állatkísérletekben vélhetően megelőzi a tumorok kialakulását és vélhetőleg hatékony a már létező tumorok ellen. Szintén állatkísérletekben javítja az agyi funkciókat, késlelteti a korral együtt járó kognitív hanyatlást és lassíthatja az agy funkcióvesztését; sztrók során csökkenti az agyat érő károsodást és gyorsítja a felépülést; szklerózis multiplexben enyhítheti a tüneteket és a lassíthatja betegség romlását. (Phillips 2019)
Az alábbiakban az anyagcsere szempontjából legfontosabb fiziológiás hatások közül emelünk ki néhányat:
- Javul az inzulinérzékenység, amitől böjtölés után kevesebb inzulinra lesz szükség. (Prasetya et al, 2018)
- Csökken a test általános gyulladásszintje, pl. a TNF-α (tumor nekrózis faktor) és a citokinek (gyulladásos markerek, pl. interleukin-6) szintje. Ezt számos kutatás kimutatja a Ramadan (muszlim böjti hónap) kapcsán. (Mushtaq et al, 2019; Faris et al, 2012; Ünalacak et al, 2011)
- Növekszik az antioxidáns hálózat, amely véd az anyagcsere-folyamatok során keletkező szabadgyökök káros hatásai ellen. (Gîlcă et al, 2003.)
- Növekszik a HGH (human growth hormone, humán növekedési hormon) termelése. EZ a hormon hatásai közé tartozik az izomtömeg építése, a zsírégetés fokozása, továbbá segít felépíteni, fenntartani és helyreállítani az egészséges szöveteket az izmokban, az agyban és más szervekben. Pozitív hatásai miatt egyre népszerűbb injekció-kúra formájában is annak ellenére, hogy ilyen formában és dózisban alkalmazva súlyos mellékhatásokkal járhat.
Egy érdekes kutatásban egy 41 éves szerzetes 40 napon át böjtölt orvosi felügyelet mellett. A jelentős élettani változások között a HGH erős növekedését is mérték nála: a böjt 26. napján a HGH szintje a böjt előtti érték több mint 13-szorosa volt, de még a legalacsonyabb érték is 4-szeres volt (az 5. napon). (Kerndt et al, 1982) Egy 9 egészséges férfit vizsgáló kutatásban már egy 48 órás böjtben is megfigyelték a HGH-termelés mennyiségének és frekvenciájának (a kiválasztás gyakoriságának) növekedését. Elhízottakban ugyanakkor ez a változás fordított arányt mutatott (Hartman et al, 1992), ami újabb érv arra, hogy akinek túlsúlya van, az sürgősen fogyjon le. - Beindul az autofágia (lásd lejjebb.)
- Új immunsejtek generálódnak, erősödnek az immunfunkciók. (Qian et al, 2021)
- Őssejtek termelődnek, amelyek támogathatják a test javító mechanizmusait. (González-Estévez, 2020. ) Ehhez viszont nem biztos, hogy elég a 12 órás böjt, itt a többnapos koplalás lehet hatásos. Egy kutatásban 6-20 napig tartó böjtre fogott laposférgekben figyelték meg az őssejtek funkcióinak javulását. (Iglesias et al, 2019.) Egy másik kutatásban egerekben 24 órás böjt után észlelték a bélhámsejtek őssejtjeinek fokozódó aktivitását, de az egerek anyagcseréje gyorsabb és élethosszuk rövidebb, tehát az egérmodellek eredményeit vélhetően fel kell szorozni. (Mihaylova et al, 2018)
- Regenerálódik az emésztőrendszer: helyreállnak a bélsejtek közti szoros kapcsolatok (tight junctions), az éhezést jobban tűrő mikrobiom (bélflóra) szaporodik, a sérült bélhámsejtek regenerálódnak.
- A ráksejtek potenciálisan meggyengülnek, mert tápanyag nélkül maradnak, ami csökkentheti a szaporodásuk, elvándorlásuk és túlélésük esélyét, valamint az apoptózis (programozott sejthalál) és a kemoterápia hatásainak erősödését eredményezheti. (Sergeeva et al, 2023) A böjt emiatt a metabolikus onkológia egyik gyakori terápiás eszköze.
- Beindul a DNS regeneráció (egyes génhibák kijavítása). Egy kutatásban 24 órás koplalás után figyelték meg, hogy a kemoterápiás kezelés alatt álló egerek vékonybélhám szövete 24 órás koplalás hatására épebb maradt, ami növelte a DNS-javító és DNS-károsodásra reagáló gének számát. (Tinkum et al, 2015.)
A fenti folyamatok révén a böjtölés számos állapotban hasznunkra lehet, akár a megelőzést, akár egy már kialakult betegséget tekintve. Ezekre az egyes diagnózisfajták kapcsán alatt hozunk kutatási eredményeket.
A böjt nem fiziológiás hatásai
- Javítja az ételekkel való pszichés kapcsolatot; csökkenti az evéshez való addiktív vagy érzelemvezérlet viszonyt.
- Csökkenti a hangulatingadozásokat, növeli az érzelmi stabilitást.
- A testről segít áttenni a figyelmet a lélekre és a transzcendentálisra. (Nem véletlenül javasolja számos vallási hagyomány.)
- Pénzt spórol meg, hiszen nem kell nasira és pótevésre költenünk.
- Időt spórol meg; nem kell az étel beszerzésével, elkészítésével és elfogyasztásával foglalkoznunk.
Autofágia
Az autofágia a modern egészség- és fitneszipar egyik új üdvöskéje, amelyről az 1990-es évekig nem tudtunk. A köztudatba 2016-ban került be, amikor Ószumi Josinori japán tudós Nobel-díjat kapott autofágiával foglalkozó kutatási eredményeiért, melyek során élesztő-baktériumokban figyelte meg ezt a folyamatot.
Az autofágia ön-emésztést jelent, melynek során a sejt felszámolja a sérült sejtrészeit. Egy membrán megkeresi és körbeveszi a sérült sejtrészeket (régi sejtmembránokat, sejtszervecskéket, sejttörmelékeket, fehérjéket), kialakít egy ún. autofagoszómát, majd a lizoszóma nevű emésztő-funkciójú részecskével egyesülve elemeire bontja a körbevett részecskéket.
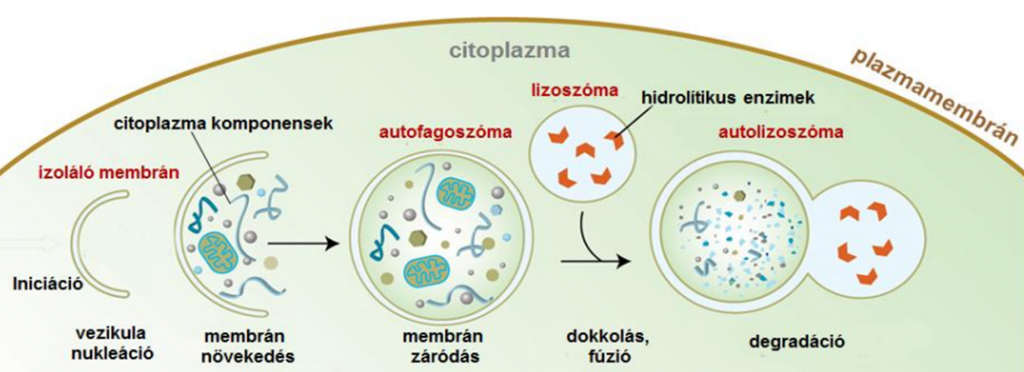
Az autofágia célja tehát a sejten belüli homeosztázis (egyensúlyi állapot) fenntartása, ami a sejten belüli takarításként fogható fel – ellentétben a sejten kívüli betolakodók eltakarításával, amit fagocitózisnak nevezünk. Az autofágia kimenete lehet emésztés (ilyenkor a megemésztett részecskékből energia lesz) vagy újrahasznosítás (ilyenkor a sejtrészecske ugyanarra vagy valamilyen más funkcióra újraépül). Autofágia valamilyen mértékben mindig zajlik a sejtjeinkben, de bizonyos ingerek hatására magasabb fokozatra kapcsol. Ilyen inger lehet az alacsony inzulinszint (étrendi vagy böjti ketózisban), az aminosavak alacsony szintje a sejtben (kb. 15 g napi fehérjebevitel alatt ) (Mortimore at el, 1989) (Dunn et al, 2018) (Lorin et al, 2015). További tényezők lehetnek a túlhevülés vagy a hypoxia. Sejtszinten az autofágia jelutak meglepően sok közös pontot mutatnak az öregedést szabályzó faktorokkal. (Badadani , 2021) Ahogy öregszünk, vélhetően emiatt is csökken az autofágia hatékonysága. Ezt a bőrsejtekben is kimutatták (Kim et al, 2018, Tashiro et al 2013) – ahogyan öregszünk, a bőrsejtekben gyorsabban szaporodnak fel a melléktermékek, mint amilyen gyorsan azt az autofágia el tudja takarítani. Ezért az életkorunk előrehaladtával az autofágia csökkenését valószínűleg érdemes tudatosan ellensúlyoznunk.
A böjtben beinduló „karbantartás” és öngyógyítás számos területen játszik fontos szerepet: az öregedés lassítása, a kalóriamegvonás és alultápláltság átvészelése, egyes idegrendszeri betegségek, pl. Alzheimer vagy Parkinson-kór (Nixon et al, 2012), multiplex sclerosis (Choi et al, 2016), fertőzések és tumorok legyőzése.
Az autofágia számos célpontra irányulhat:
- Hibásan felgombolyodott fehérjék (misfolded proteins). Ilyenkor a fehérje nem megfelelő térszerkezetet vesz fel, ami hozzájárulhat egyes neuro-degeneratív betegségek vagy allergiák kialakulásához.
- Különféle patogének: vírusok, baktériumok, gombák, penészspórák.
- Toxinok: ide tartoznak a kemoterápiás gyógyszerek is, amelyek a daganatsejteket ugyan elpusztítják, de az egészséges sejtek számára is mérgezést okoznak. Ezért fontos kemoterápia során koplalással fokozni az autofágiát.
- AGE-ek (előrehaladott glikációs végtermékek): fehérjekárosodás, amiben cukor kötődik a fehérjékhez. Ez így kialakult molekulák károsítják a fehérjék stabilitását és funkcionalitását.
- Sérült mitokondriumok (pl. ráksejtekben).
- Fölöslegessé vált szövetek, pl. túlburjánzott hegszövet, terhesség vagy jelentős fogyás után megmaradó lógó bőr.
Milyen módszerekkel erősíthető az autofágia?
- Böjt: minimum 18 órás, de lehet több napos vagy a helyzet súlyosságától függően akár több hetes is. (Kröpfl et al, 2022, Bagherniya et al, 2018)
- Kalóriamegvonás: ilyen pl. a böjt-utánzó étrend (fasting-mimicking diet), amely 5-napos ciklikusokba osztott kalóriacsökkentésen alapul. A részleteket itt írtuk le.
- Étrendi ketózis.
- Ritka, de tartalmas étkezések: napi egy étkezés (OMAD, one meal a day).
- Rendszeres sport: erősítés és aerób edzés.
- Megfelelő minőségű és hosszú alvás.
- HBOT (hyperbaric oxygen therapy): nagynyomású oxigén kezelés.
- Hypoxia (oxigénhiány): magaslaton tartózkodás, Wim Hof légzés.
- Hideg/meleg kitettség (pl. hidegzuhany és/vagy szauna).
Ugyanakkor tudni érdemes, hogy az autofágia nem csodamódszer, ami minden bajt meggyógyít. A daganatos betegségek bizonyos szakaszaiban például kifejezetten gátolni kell az autofágiát, mert a tumorsejtek terjedésének kedvez. Erről bővebben a Daganatos betegségek menüpontban írunk.
Hivatkozások
Badadani M. Autophagy Mechanism, Regulation, Functions, and Disorders. 2012. https://www.hindawi.com/journals/isrn/2012/927064/
Bagherniya M, Butler AE, Barreto GE, Sahebkar A. The effect of fasting or calorie restriction on autophagy induction: A review of the literature. 2018. https://pubmed.ncbi.nlm.nih.gov/30172870/
Choi IY, Piccio L, Childress P, Bollman B, Ghosh A, Brandhorst S, Suarez J, Michalsen A, Cross AH, Morgan TE, Wei M, Paul F, Bock M, Longo VD. A Diet Mimicking Fasting Promotes Regeneration and Reduces Autoimmunity and Multiple Sclerosis Symptoms. 2016. https://pubmed.ncbi.nlm.nih.gov/27239035/
Dunn JD, Bosmani C, Barisch C, Raykov L, Lefrançois LH, Cardenal-Muñoz E, López-Jiménez AT, Soldati T. Eat Prey, Live: Dictyostelium discoideum As a Model for Cell-Autonomous Defenses. 2018. https://pubmed.ncbi.nlm.nih.gov/29354124/
Faris MOE, Kacimi S, Al-Kurd RA, Fararjeh MA, Bustanji YK, Mohammad MK, Salem ME. Intermittent fasting during Ramadan attenuates proinflammatory cytokines and immune cells in healthy subjects. 2012. https://pubmed.ncbi.nlm.nih.gov/23244540/
Gîlcă M, Soian I, Mohora M, Petec C, Muscurel C, Dinu V. The effect of fasting on the parameters of the antioxidant defence system in the blood of vegetarian human subjects. 2003. https://pubmed.ncbi.nlm.nih.gov/15526512/
González-Estévez C, Flores I. Fasting for stem cell rejuvenation. 2020. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7093158/
Hartman ML, Veldhuis JD, Johnson ML, Lee MM, Alberti KG, Samojlik E, Thorner MO. Augmented growth hormone (GH) secretory burst frequency and amplitude mediate enhanced GH secretion during a two-day fast in normal men. 1992. https://pubmed.ncbi.nlm.nih.gov/1548337/
Iglesias M, Felix DA, Gutiérrez-Gutiérrez Ó, Del Mar De Miguel-Bonet M, Sahu S, Fernández-Varas B, Perona R, Aboobaker AA, Flores I, González-Estévez C. Downregulation of mTOR Signaling Increases Stem Cell Population Telomere Length during Starvation of Immortal Planarians. 2019. https://pubmed.ncbi.nlm.nih.gov/31353226/
Nixon RA, Yang DS. Autophagy and Neuronal Cell Death in Neurological Disorders. 2012. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3475163/
Kerndt PR, Naughton JL, Driscoll CE, DA Loxterkamp. Fasting: the history, pathophysiology and complications. 1982. https://pubmed.ncbi.nlm.nih.gov/6758355/
Kim HS, Park SY, Moon SH, Lee JD, Kim S. Autophagy in Human Skin Fibroblasts: Impact of Age. 2018. https://pubmed.ncbi.nlm.nih.gov/30071626/
Kröpfl JM, Morandi C, Gasser BA, Schoch R, Schmidt-Trucksäss A, Brink M. Lymphocytes are less sensitive to autophagy than monocytes during fasting and exercise conditions. 2022. https://pubmed.ncbi.nlm.nih.gov/35852665/
Lorin S, Meijer AJ, Codogno P. Autophagy: Cancer, Other Pathologies, Inflammation, Immunity, Infection, and Aging. Chapter 2 – Regulation of Autophagy by Amino Acids. 2015. https://www.sciencedirect.com/book/9780128010327/autophagy-cancer-other-pathologies-inflammation-immunity-infection-and-aging
Mihaylova M, Cheng CW, Cao AQ, Tripathi S, Mana MD, Bauer-Rowe KE, Abu-Remaileh M, Clavain L, Erdemir A, Lewis CA, Freinkman E, Dickey AS, La Spada AR, Huang Y, Bell GW, Deshpande V, Carmeliet P, Katajisto P, Sabatini DM, Yilmaz ÖH: Fasting Activates Fatty Acid Oxidation to Enhance Intestinal Stem Cell Function during Homeostasis and Aging. 2018. https://pubmed.ncbi.nlm.nih.gov/29727683/
Mortimore GE, Pösö AR, Lardeux BR. Mechanism and regulation of protein degradation in liver. 1989. https://pubmed.ncbi.nlm.nih.gov/2649336/
Mushtaq R, Akram A, Mushtaq R, Khwaja S, Ahmed S. The role of inflammatory markers following Ramadan Fasting. 2019. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6408667/
Phillips MCL: Fasting as a Therapy in Neurological Disease. 2019. https://pubmed.ncbi.nlm.nih.gov/31627405/
Prasetya G, Sapwarobol S. Intermittent Fasting During Ramadan Improves Insulin Sensitivity and Anthropometric Parameters in Healthy Young Muslim Men. 2018. https://pubmed.ncbi.nlm.nih.gov/33786036/
Qian J, Fang Y, Yuan N, Gao X, Lv Y, Zhao C, Zhang S, Li Q, Li L, Xu L, Wei W, Wang J. Innate immune remodeling by short-term intensive fasting. 2021. https://pubmed.ncbi.nlm.nih.gov/34705313/
Sergeeva E, Ruksha T, Fefelova Y: Effects of Obesity and Calorie Restriction on Cancer Development. 2023. https://pubmed.ncbi.nlm.nih.gov/37298551/
Tashiro K, Shishido M, Fujimoto K, Hirota Y, Yo K, Gomi T, Tanaka Y. Age-related disruption of autophagy in dermal fibroblasts modulates extracellular matrix components. 2013. https://pubmed.ncbi.nlm.nih.gov/24287182/
Tinkum KL, Stemler KM, White LS, Loza AJ, Jeter-Jones S, Michalski BM, Kuzmicki C, Pless R, Stappenbeck TS, Piwnica-Worms D, Piwnica-Worms H. Fasting protects mice from lethal DNA damage by promoting small intestinal epithelial stem cell survival. 2015. https://pubmed.ncbi.nlm.nih.gov/26644583/
Ünalacak M, Kara IH, Baltaci D, Erdem Ö, Bucaktepe PG. Effects of Ramadan fasting on biochemical and hematological parameters and cytokines in healthy and obese individuals. 2011. https://pubmed.ncbi.nlm.nih.gov/21235381/
Xu K, Morgan KT, Todd Gehris A, Elston TC, Gomez SM: A Whole-Body Model for Glycogen Regulation Reveals a Critical Role for Substrate Cycling in Maintaining Blood Glucose Homeostasis. 2011. https://pubmed.ncbi.nlm.nih.gov/22163177/